Дегазация углекислого газа
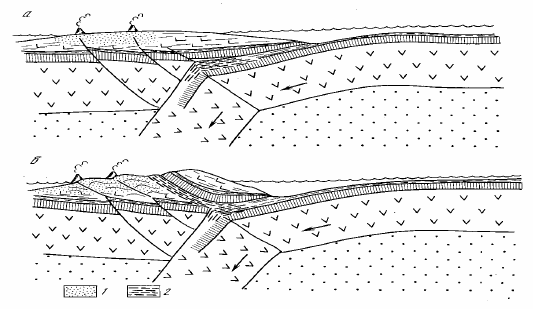
Рисунок 94. Происхождение офиолитовых покровов и парных поясов метаморфизма в островных дугах:
1 — область высокотемпературного метаморфизма низкого давления; 2 — глаукофановые сланцы — продукты низкотемпературного метаморфизма высокого давления.
В качестве одного из граничных условий примем, по А. Б. Ронову и А. А. Ярошевскому (1978), что в карбонатах земной коры связано около 3,91×1023 г CO2, кроме того, в коре содержится ещё около 1,95×1022 г органического углерода (Cорг). С этим количеством Cорг до его восстановления биологическими процессами было связано 5,2×1022 г кислорода. Следовательно, общая масса дегазированного из мантии CO2 составляет m(CO2) ≈ (3,91 + 0,72)×1023 = 4,63×1023 г.
Значительно сложнее определить содержание углерода (или CO2) в мантии Земли. По имеющимся экспериментальным данным, в высокотемпературных фракциях отгонки летучих компонентов в кислородной атмосфере из закалочных стёкол толеитовых базальтов океанических рифтовых зон обычно содержится от 20 до 170 г/т углерода мантийного происхождения с изотопными сдвигами около — 5 ‰, (Watanabe et al., 1983; Sakal et al., 1984; Exiey et а1., 1986). К сожалению значительный разброс эмпирических определений не позволяет уверенно оценить среднее содержание углерода и CO2 в мантии. Однако следует учитывать, что часть мантийного углерода находится в атомарном состоянии, рассеяна по кристаллическим решёткам силикатов (Watanabe et а1., 1983) и поэтому не является летучим компонентом базальтовых расплавов. Следовательно, содержание углерода в газовой фазе CO2 базальтовых выплавок может оказаться заметно меньшим приведённых здесь значений суммарных концентраций углерода. Для определённости примем содержание подвижного углерода в мантии около 30 г/т, или в пересчёте на углекислый газ 110 г/т (1,1×10-4). В этом случае в мантии содержится около m(CO2) ≈ 4,48×1023 г CO2.
Теперь можно оценить суммарную массу CO2 в Земле (с пересчётом Cорг в CO2), что составит m(CO2) ≈ 9,11×1023 г. В этом случае по уравнению (30) находим χ(CO2) ≈ 0,71. По уравнениям (29) и (30) легко построить кривые скорости дегазации углекислого газа из мантии (рис. 118) и накопления CO2 во внешних геосферах Земли — в атмосфере, гидросфере и земной коре (рис. 119).
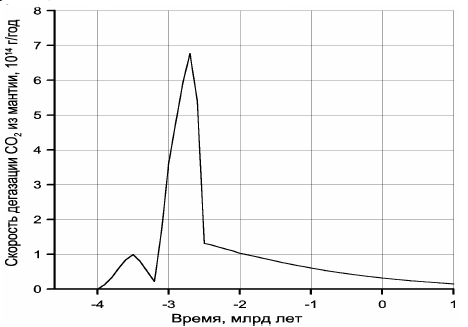
Рисунок 118. Скорость дегазации углекислого газа из мантии
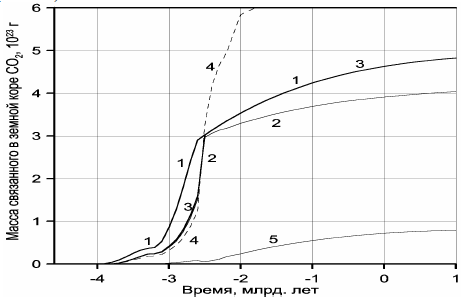
Рисунок 119. Масса углекислого газа связанная в земной коре:
1 — масса дегазированного из мантии CO2; 2 -накопление массы углекислого газа к карбонатном резервуаре земной коры; 3 — суммарная масса связанного углекислого газа (в карбонатном и биогенном резервуарах), в масштабе графиков кривые 1 и 3 в протерозое и фанерозое сливаются воедино; 4 — масса связанной в земной коре воды; 5 — масса органического углерода в пересчёте на CO2.
Обращает на себя внимание резкое отличие кривой дегазации углекислого газа от дегазации воды (см. рис. 113). Это связано с меньшей теплотой образования воды и её диссоциацией на металлическом железе в процессе зонной дифференциации земного вещества в архее. Пик скорости дегазации CO2 приходится на время максимальной тектонической активности Земли, около 2,7 млрд лет назад, тогда как с максимальной скоростью дегазация воды происходила около 2,5 млрд лет назад, т.е. только после образования у Земли плотного ядра и перехода процесса дифференциации земного вещества от механизма зонной плавки к более спокойному бародиффузионному механизму дифференциации мантийного вещества.
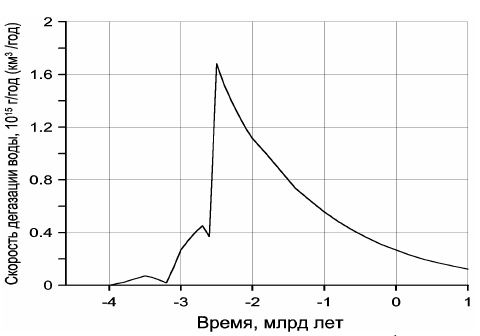
Рисунок 113. Скорость дегазации воды из мантии в гидросферу Земли
Если бы весь дегазированный углекислый газ сохранялся в атмосфере, то его парциальное давление сейчас достигало бы 90-100 атм, т.е. было бы таким же, как и на Венере. К счастью для жизни на Земле, одновременно с поступлением CO2 в атмосферу происходило его связывание в карбонатах. Но для протекания этой реакции необходима вода в жидкой фазе, так как только в этом случае гидратация силикатов сопровождается поглощением CO2 с образованием карбонатов:
Формула 47. Связывание углекислого газа в карбонатах: анортит — каолин — кальцит
Формула 48. Связывание углекислого газа в карбонатах: оливин — серпентин — магнезит
По этой причине существенное влияние на эволюцию парциального давления углекислого газа в атмосфере оказала история развития океанов на Земле (см. рис. 112).
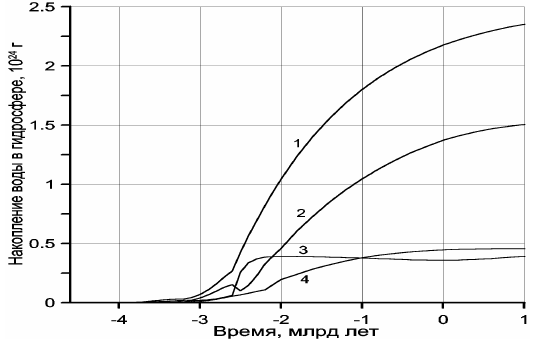
Рисунок 112. Накопление воды в гидросфере Земли:
1 — суммарная масса дегазированной из мантии воды; 2 — масса воды в океане; 3 — масса воды, связанная в океанической коре; 4 — масса воды, связанная в континентальной коре.
Как видно из типовых реакций (47) и (48), на каждые две молекулы CO2, связываемые в карбонатах, расходуются четыре молекулы воды на гидратацию породообразующих минералов океанической или континентальной коры. Отсюда следует, что при избытке углекислого газа в атмосфере и гидросфере практически все реакции гидратации горных пород будут сопровождаться связыванием CO2 в карбонатах, причём на единицу массы связанной в породах воды будет приходиться приблизительно 1,22 массы углекислого газа. При недостатке CO2 гидратация части силикатов будет протекать без связывания углекислого газа, например, по реакциям типа (38).
Суммарная масса воды, связанная в породах земной коры, нами была оценена выше — это сумма кривых 3 и 4 на рис. 112, частично воспроизведённая и на рис. 119 (кривая 4). Отсюда можно рассчитать и массу углекислого газа, который мог быть связан в карбонатах. Поскольку жизнь в океане лимитируется содержанием фосфора в океанической воде, а растворимость фосфора сравнительно невелика (Шопф, 1982), то можно предполагать, что абсолютная масса органических веществ в океане пропорциональна его массе. Поэтому массу органического углерода в пересчёте на CO2 в архее и протерозое можно оценить, считая, что она в первом приближении пропорциональна массе воды в Мировом океане, изображённой на рис. 112 кривой 2.
На рис. 119 приведено сравнение массы дегазированного из мантии углекислого газа (кривая 1) с массой CO2, связанного в карбонатах (кривая 2), а также с суммарной массой CO2 в карбонатном и биогенном резервуарах (кривая 3). Отдельно воспроизведена кривая накопления органического углерода в океанических осадках, пересчитанная на массу CO2 (кривая 5). Как видно из рис. 119, в протерозое и фанерозое почти весь дегазированный из мантии углекислый газ оказался связанным в карбонатном или биогенном (в форме Cорг) резервуарах, тогда как массу CO2, находящуюся в атмосфере и растворенную в гидросфере этих эпох, в масштабе приведённых на рисунке графиков показать не удаётся. Иная ситуация существовала в архее. Из-за малого количества воды в архейских океанах масса связанного CO2 в то время была существенно меньшей, чем масса дегазированного из мантии углекислого газа. Отсюда следует, что в архее заметная часть углекислого газа должна была находиться в атмосфере и быть растворенной в водах океана.
Помимо связанного в породах CO2 часть углекислого газа (в форме анионов HCO3-) всегда оказывается растворенной в водах океана. Учёт этой части CO2 проведём по методике, предложенной Н. О. Сорохтиным (2001). Для этого учтём, что растворимость углекислого газа в воде, согласно закону Генри, прямо пропорциональна его парциальному давлению в атмосфере:
Формула 49. Растворимость углекислого газа в воде, согласно закона Генри
где C(CO2)ок — концентрация углекислого газа в океанических водах; K(CO2) — константа Генри; p(CO2) — парциальное давление углекислого газа в атмосфере. Но растворимость газов в воде экспоненциально зависит от её температуры Т:
Формула 50. Растворимость газов в воде в зависимости от температуры
где V(CO2) — парциальный мольный объем растворенного в воде CO2 в бесконечно разбавленном растворе; R = 1,987 кал/моль град; K0 — нормировочный коэффициент. Эмпирическая зависимость показателя константы Генри от температуры приведена в Справочнике термодинамических величин (Наумов и др., 1971). Для нахождения нормировочного коэффициента K0, предварительно надо найти эффективное значение константы Генри для современного океана. Учитывая, что в современном океане растворено приблизительно 1,4×1020 г CO2, тогда как парциальное давление этого газа в атмосфере составляет 0,46 мбар, по выражению (49) можно оценить эффективное значение коэффициента Генри для океана Kok ≈ 0,213. Учитывая, что средняя температура современной Земли равна 288 К (14,8 °С), находим значение нормировочного коэффициента в выражении (50) K0 = 0,803.
Теперь легко найти и массу углекислого газа, растворенного в водах океана:
Формула 51. Масса углекислого газа, растворённого в водах океана
В позднем архее около 2,7 млрд лет назад масса растворенного в океане углекислого газа, судя по расчётам (разность кривых 1 и 3 на рис. 119), достигала 10 г при массе воды в океане того времени около 1,32×1023 г (см. кривую 2 на рис. 112). Отсюда видно, что концентрация растворенного углекислого газа в океанических водах тогда достигала 40 %! Это означает, что при средней температуре океанов около 55 °С (см. ниже), океанические воды в позднем архее были горячими и кислыми, а следовательно, весьма агрессивными растворителями многих веществ.
На рис. 120 приведён рассчитанный Н. О. Сорохтиным (2001) график эволюции парциального давления углекислого газа в атмосфере с учётом его частичного растворения в океанических водах. Подчеркнём, что условия для возникновения углекислотной атмосферы существовали только в архее. В протерозое и фанерозое подавляющая часть углекислого газа оказалась связанной в карбонатах и органическом веществе, а в атмосфере и гидросфере сохранилась лишь его малая часть, определяемая законом действующих масс реакций связывания CO2 в горных породах и биосфере.
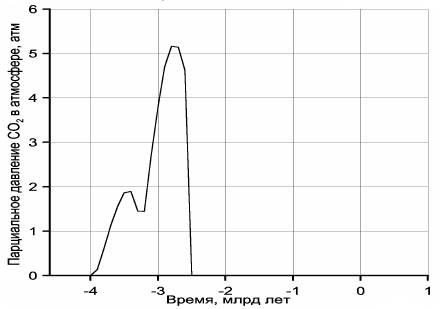
Рисунок 120. Эволюция парциального давления углекислого газа в земной атмосфере
(в протерозое и фанерозое парциальное давление CO2 не превышало 1 мбар и в масштабе графика неразличимо).